化学方程式的配平方法(三种实用方法归纳总结)
季乐天 • 2022-06-23 23:20:05 • 5832次 • 热点
化学方程式的配平很重要,考试中会考化学方程式的书写以及相关计算,如果化学方程式书写就错了,那后面的计算就白出力了。
化学方程式的配平有多种方法,在这只讲三种常用方法,在初中学习阶段,这三种方法已足够。
一、观察法
初中许多化学方程式比较简单,通过简单的观察就能配平。
方法:从化学式较复杂的物质入手,根据质量守恒定律,推求反应物和生成物的化学计量数,直至配平。
步骤:(1)从化学式较复杂的一种生成物推求有关反应物化学式的化学计量数和这一生成物的化学计量数;
(2)根据求得的化学式的化学计量数,再找出其它化学式的化学计量数,这样即可配平。
例如:Fe2O3 + CO——Fe + CO2
观察:
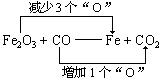
所以,1个Fe2O3应将3个“O”分别给3个CO,使其转变为3个CO2。
即Fe2O3 + 3CO——Fe + 3CO2
再观察上式:左边有2个Fe(Fe2O3),所以右边Fe的系数应为2。
即Fe2O3 + 3CO -----2Fe + 3CO2
这样就得到配平的化学方程式了,注意将“—”线变成“=”号。
即Fe2O3 + 3CO == 2Fe + 3CO2
【练习】
1、 CO + Fe3O4 —— Fe + CO2
2、 C + Fe2O3—— Fe + CO2
二、最小公倍数法
方法: 找出式子两边只出现一次,并且原子数相差较大的元素,求出最小公倍数,进而确定反应物和生成物的化学计量数。
步骤:(1)求出每一种原子在反应前后的最小公倍数;(2)使该原子在反应前后都为所求出的最小公倍数;(3)一般先从氧原子入手,再配平其他原子。
例: 配平Al + Fe3O4 → Fe + Al2O3
第一步:配平氧原子 Al + 3Fe3O4 ---- Fe + 4Al2O3
第二步:配平铁和铝原子 8Al + 3Fe3O4 ---- 9Fe + 4Al2O3
第三步:配平的化学方程式 8Al + 3Fe3O4 -----9Fe + 4Al2O3
【练习】
1、 Al + O2—— Al2O3
2、 Fe + O2—— Fe3O4
三、定一法
适用条件:如大多数碳氢化合物或含碳氢氧的化合物与氧气的反应,以及某些分解反应。
配平:

解析:先设定C2H5OH的系数为1,再确定CO2的系数为2,H2O的系数为3。方程式右边氧原子总数为7,C2H5OH中有一个氧原子,可确定O2的系数为3。
配得结果为

【练习】
1、 C2H2 + O2 —— CO2 + H2O
2、 C6H6 + O2 —— CO2 + H2O
猜你喜欢
相关推荐
-
各位朋友们好,要是你对hcl是什么化学名称,以及HCl是什么意思不是很清楚,没关系,今天小编就为大家解答一下。希望可以帮助到有需要的朋友,下面就来解答关于hcl是什么化学名称的问题,下面......
-
小伙伴们,你们好,若是你对h2so4是什么化学名称,和hso2-4化学式名称不是很明白,今天小编给大家科普一下具体的知识。希望可以帮助到有需要的朋友,下面就来解答关于h2so4是什么化学......
-
各位伙伴们好,要是你对so4是什么化学名称,以及SO4是什么不是很清楚,今天小编给大家科普一下具体的知识。希望可以帮助到有需要的朋友,下面就来解答关于so4是什么化学名称的问题,下面我们......
-
各位朋友们好,如果你对二氧化碳与氢氧化钠反应,和二氧化碳与氢氧化钠反应生成什么不是很了解,没关系,今天小编就为大家解答一下。希望可以帮助到各位,下面就来解答关于二氧化碳与氢氧化钠反应的问......
-
各位朋友们好,如果你对ch3cooh是什么化学名称,以及ch3cooh是什么意思不是很清楚,今天小编给大家科普一下具体的知识。希望可以帮助到有需要的朋友,下面就来解答关于ch3cooh是......
-
洪天王自已进了天国,天京帝宫的享乐,奢侈糜烂的生活,美女宫妃的削骨夺魂,天国里宫廷权斗内耗,不亚于朝中儒狗争权夺利,出生入死期望满满的天国兵勇天国梦破,在皇犬儒狗势力刮地式洗劫,血腥劫光......
-
山海经十大祥瑞之兽:1、凤凰;2、麒麟;3、朱雀;4、青鸾;5、九尾狐;6、当康;7、貔貅;8、乘黄;9、金蟾;10、螭龙。祥瑞之兽指的是在山海经中的传说故事里有着很好寓意的神兽,而且每......
-
三省六部制雏形产生于南北朝时期北周,正式形成于隋朝,完善于唐朝。三省六部制是中国古代封建社会一套组织严密的中央官制。它始于隋朝五省六曹制,确立于唐朝,此后一直到清末,六部制基本沿袭未改。...
-
郑和下西洋在国内的影响在南洋、印度洋沿岸,开拓了愈来愈多的海外市场。海外贸易刺激了国内官私工业和民间手工业的迅速发展。郑和下西洋加强了祖国大陆与台湾的联系。郑和下西洋在国外的影响郑和下西......
-
十大经典原始社会穿越小说:《原始战记》、《放开那个原始人》、《厉害了我的原始人》、《成神从原始部落开始》、《万古最强部落》、《我是一个原始人》、《重生原始时代》、《传奇族长》、《酋长别打......
-
商鞅变法(公元前356年和公元前350年),战国时期秦国秦孝公支持商鞅进行的一次较为彻底的封建化变法改革运动。商鞅变法运动壮大了秦国国力,为秦后来统一天下奠定了基础。它推动了奴隶制社会向......
-
三体文明等级排序:地球文明、三体文明、歌者文明、边缘文明。其中边缘文明和歌者文明曾经打过一架,但是边缘文明胜利了,而歌者文明只能大规模使用二向箔进行挽回,这也可以看出边缘文明更强一点。...
-
三维空间和四维空间的含义不同:三维以上的空间,一般统称高维空间。四维空间是一个时空的概念。简单来说,任何具有四维的空间都可以被称为“四维空间”。日常生活所提及的“四维空间”,大多数都是指......
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 toplearningteam@gmail.com 举报,一经查实,本站将立刻删除。











